Tensión superficial
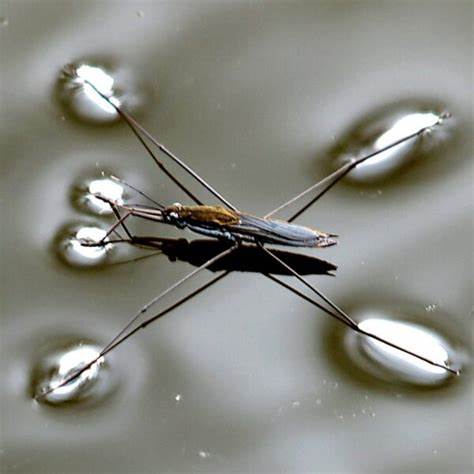

En física, se denomina tensión superficial de un líquido a la cantidad de energía necesaria para aumentar su superficie por unidad de área. Esta definición implica que el líquido presenta una resistencia al aumentar su superficie, lo que en efecto permite a algunos insectos, como el zapatero (Gerris lacustris), poder desplazarse por la superficie del agua sin hundirse. La tensión superficial (una manifestación de las fuerzas intermoleculares en los líquidos), junto a las fuerzas que se dan entre los líquidos y las superficies sólidas que entran en contacto con ellos, da lugar a la capilaridad. Como efecto tiene la elevación o depresión de la superficie de un líquido en la zona de contacto con un sólido.
Otra posible definición de tensión superficial: es la fuerza que actúa tangencialmente por unidad de longitud en el borde de una superficie libre de un líquido en equilibrio y que tiende a contraer dicha superficie. Las fuerzas cohesivas entre las moléculas de un líquido son las responsables del fenómeno conocido como tensión superficial.
La tensión superficial se debe a que las fuerzas que afectan a cada molécula son diferentes en el interior del líquido y en la superficie. Así, en el seno de un líquido cada molécula está sometida a fuerzas de atracción que en promedio se anulan. Esto permite que la molécula tenga una energía bastante baja. Sin embargo, en la superficie hay una fuerza neta hacia el interior del líquido. Rigurosamente, si en el exterior del líquido se tiene un gas, existirá una mínima fuerza atractiva hacia el exterior, aunque en la realidad esta fuerza es despreciable debido a la gran diferencia de densidades entre el líquido y gas.
Otra manera de verlo es que una molécula en contacto con su vecina está en un estado menor de energía que si no estuviera en contacto con dicha vecina. Las moléculas interiores tienen todas las moléculas vecinas que podrían tener, pero las partículas del contorno tienen menos partículas vecinas que las interiores y por eso tienen un estado más alto de energía. Para el líquido, el disminuir su estado energético es minimizar el número de partículas en su superficie.
Energéticamente, las moléculas situadas en la superficie tiene una mayor energía promedio que las situadas en el interior, por lo tanto la tendencia del sistema será disminuir la energía total, y ello se logra disminuyendo el número de moléculas situadas en la superficie, de ahí la reducción de área hasta el mínimo posible.

Como resultado de minimizar la superficie, esta asumirá la forma más suave que pueda ya que está probado matemáticamente que las superficies minimizan el área por la ecuación de Euler-Lagrange. De esta forma el líquido intentará reducir cualquier curvatura en su superficie para disminuir su estado de energía de la misma forma que una pelota cae al suelo para disminuir su potencial gravitacional.
La tensión superficial suele representarse mediante la letra griega (gamma), o mediante (sigma). Sus unidades son de N·m−1, J·m−2, kg·s−2 o dyn·cm−1 (véase análisis dimensional).
Algunas propiedades de :
1. Método del anillo de du Noüy: Calcula la F necesaria para separar de la superficie del líquido un anillo. F=4πR (siendo R el promedio del radio externo e interno del anillo).
2. Método del platillo de Wilhelmy: Medida de la F para separar la superficie de una delgada placa de vidrio. Precisión de 0,1 %.
Tensiómetro (Método de presión de burbuja): En un líquido a T constante se introduce un capilar de radio R conectado a un manómetro. Al introducir gas se va formando una burbuja de radio r a medida que aumenta la P en el manómetro. Al crecer r disminuye hasta un mínimo, r=R y después vuelve a aumentar. Esto hace posible su uso en ambos, laboratorios de investigación y desarrollo, así como monitoreo del proceso directamente en la planta.

También se puede medir con un estalagmómetro.
Ecuaciones empíricas que se ajustan a las medidas de a distintas T.
Ecuación de Eötvös: = k/Vm2/3 (Tc-T) k= 2.1 erg/K
Ecuación de Van der Waals: =0(1-T/Tc)n; n=11/9 (liq)=8 (H2O)=1 (metales líquidos)
Para un líquido en equilibrio con su vapor dG= -SdT+VdP+dA suponiendo el sistema cerrado con dn=0. Según la condición de equilibrio termodinámico se cumple que: = (dG/dA)>0. De esta ecuación sacamos que la energía libre de Gibbs disminuye al disminuir el área superficial de un sistema, tratándose este proceso de un proceso espontáneo.
Tabla de tensiones superficiales de líquidos a 20 °C:

Escribe un comentario o lo que quieras sobre Tensión superficial (directo, no tienes que registrarte)
Comentarios
(de más nuevos a más antiguos)
Aún no hay comentarios, ¡deja el primero!

