Olefina
Los alquenos son hidrocarburos insaturados que tienen doble enlace carbono-carbono en su molécula. Se puede decir que un alqueno es un alcano que ha perdido dos átomos de hidrógeno produciendo como resultado un enlace doble entre dos carbonos. Los alquenos cíclicos reciben el nombre de cicloalquenos.
Antiguamente se les denominaba como olefinas dadas las propiedades que presentaban sus representantes más simples, principalmente el eteno, para reaccionar con halógenos y producir óleos.
La fórmula general de un alqueno de cadena abierta con un solo doble enlace es CnH2n. Por cada doble enlace adicional habrá dos átomos de hidrógeno menos de los indicados en esta fórmula.
Al igual que ocurre con otros compuestos orgánicos, algunos alquenos se conocen todavía por sus nombres no sistemáticos, en cuyo caso se sustituye la terminación -eno sistemática por -ileno, como es el caso del eteno que en ocasiones se llama etileno, o propeno por propileno.
1. Nombrar al hidrocarburo principal: Se ha de encontrar la cadena carbonada más larga que contenga el enlace doble, no necesariamente la de mayor tamaño, colocando los localizadores que tengan el menor número en los enlaces dobles, numerando los átomos de carbono en la cadena comenzando en el extremo más cercano al enlace doble. NOTA: Si al enumerar de izquierda a derecha como de derecha a izquierda, los localizadores de las insaturaciones son iguales, se busca que los dobles enlaces tenga menor posición o localizador más bajo.
2. Si la cadena principal tiene sustituyentes iguales en el mismo átomo de carbono separando por comas los números localizadores que se repiten en el átomo, estos se separan por un guion de los prefijos: di, tri, tetra, etc. Respectivamente al número de veces que se repita el sustituyente.
3. Los sustituyentes se escriben de acuerdo al orden alfabético con su respectivo localizador.
4. Si en la cadena principal existen varios sustituyentes ramificados iguales se coloca el número localizador en la cadena principal separando por un guion, y se escribe el prefijo correspondiente al número de veces que se repita con los prefijos: bis, tris, tetraquis, pentaquis, etc. Seguido de un paréntesis dentro del cual se nombra al sustituyente complejo con la terminación -IL.
5. Realizado todo lo anterior con relación a los sustituyentes, se coloca el número de localizador del doble enlace en la cadena principal separada de un guion, seguido del nombre de acuerdo al número de átomos de carbono reemplazando la terminación -ano por el sufijo -eno.
6. Si se presentan más de un enlace doble, se nombra indicando la posición de cada uno de los dobles enlaces con su respectivo número localizador, se escribe la raíz del nombre del alqueno del cual proviene, seguido de un prefijo de cantidad: di, tri, tetra, etc. y utilizando el sufijo -eno. Ej:-dieno, -trieno y así sucesivamente.
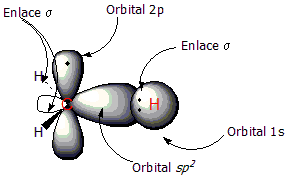
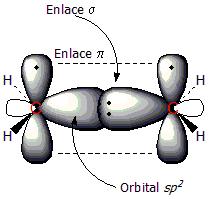
Utilizaremos el eteno como ejemplo de compuesto con doble enlace C=C. El doble enlace tiene dos componentes: el enlace tipo σ y el enlace tipo π. Los dos átomos de carbono que comparten el enlace tienen una hibridación sp2, hibridación resultante de la mezcla de un orbital 2s y dos orbitales 2p, lo cual conduce a la formación de tres orbitales sp2 de geometría trigonal plana. Al combinarse estos orbitales sp2 los electrones compartidos forman un enlace σ, situado entre ambos carbonos.
En la primera figura puede observarse el radical metilo, con un orbital sp2 que enlaza a un átomo de hidrógeno al carbono. En la segunda figura se aprecia la formación del enlace π (línea de puntos); que se forma mediante el solapamiento de los dos orbitales 2p perpendiculares al plano de la molécula. En este tipo de enlace los electrones están deslocalizados alrededor de los carbonos, por encima y por debajo del plano molecular.
Energéticamente, el doble enlace se forma mediante la edición de dos tipos de enlace, el σ y el π. La energía de dichos enlaces se obtiene a partir del cálculo del solapamiento de los dos orbitales constituyentes, y en este caso el solapamiento de los orbitales sp2 es mucho mayor que los orbitales p (el primero crea el enlace σ y el segundo el π) y por tanto la componente σ es bastante más energética que la π. La razón de ello es que la densidad de los electrones en el enlace π están más alejados del núcleo del átomo. Sin embargo, a pesar de que el enlace π es más débil que el σ, la combinación de ambos hace que un doble enlace sea más fuerte que un enlace simple.
Los alquenos se pueden sintetizar mediante las siguientes reacciones:
La presencia del doble enlace modifica ligeramente las propiedades físicas de los alquenos frente a los alcanos. De ellas, la temperatura de ebullición es la que menos se modifica. La presencia del doble enlace se nota más en aspectos como la polaridad y la acidez.
Dependiendo de la estructura, puede aparecer un momento dipolar débil.El enlace alquilo-alquenilo está polarizado en la dirección del átomo con orbital sp2, ya que la componente s de un orbital sp2 es mayor que en un sp3 (esto podría interpretarse como la proporción de s a p en la molécula, siendo 1:2 en sp2 y 1:3 en sp3, aunque dicha idea es simplemente intuitiva). Esto es debido a que los electrones situados en orbitales híbridos con mayor componente s están más ligados al núcleo que los p, por tanto el orbital sp2 es ligeramente atrayente de electrones y aparece una polarización neta hacia él. Una vez que tenemos polaridad en el enlace neta, la geometría de la molécula debe permitir que aparezca un momento dipolar neto en la molécula, como se aprecia en la figura inferior.
La primera molécula es cis y tenemos un momento dipolar neto, pero la segunda trans, pese a tener dos enlaces ligeramente polarizados el momento dipolar neto es nulo al anularse ambos momentos dipolares.
El carbono alquenílico tiene mayor acidez frente a los alcanos, debido también a la polaridad del enlace. Así, el etano (alcano) tiene un pKa de 50 (o un Ka de 10-50) frente al pKa = 44 del eteno. Este hecho se explica fácilmente considerando que, al desprenderse un protón de la molécula, queda una carga negativa remanente que en el caso del eteno se deslocaliza más fácilmente en el enlace π y σ que en el enlace σ simple que existe en un alcano. De todas formas, su acidez es menor que la de los alcoholes o los ácidos carboxílicos.
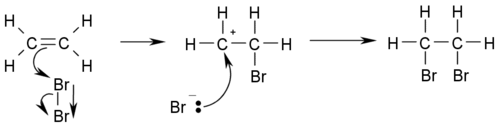
Los alquenos son más reactivos que los alcanos. Sus reacciones características son las de adición de otras moléculas, como haluros de hidrógeno, hidrógeno y halógenos. También sufren reacciones de polimerización, muy importantes industrialmente.
Estas reacciones deben seguir la Regla de Markovnikov de enlaces dobles.
=