Pirrol


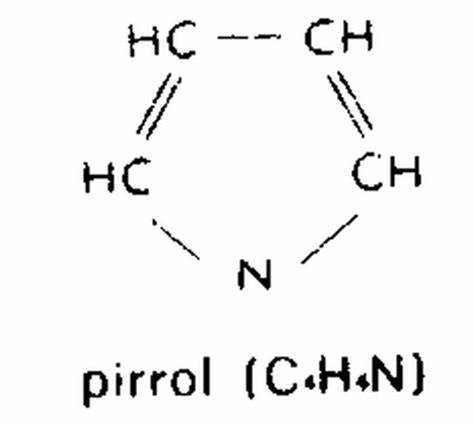
El pirrol es un compuesto químico orgánico heterocíclico aromático, un anillo de cinco miembros con la fórmula C4H5N.
Los pirroles son piezas para firmar compuestos de anillos aromáticos más largos, incluyendo las porfirinas de hemo, las clorinas y bacterioclorinas, de clorofilas y el anillo de corrina.
Los pirroles tienen una basicidad muy baja comparada con la amina y otros compuestos aromáticos como la piridina donde el anillo del nitrógeno no se enlaza al átomo del hidrógeno. Esto es porque el par de electrones sin compartir del átomo del nitrógeno se convierte en el aromático.
El pirrol experimenta la sustitución electrofílica predominante en la 2ª y 5ª posición, aunque el producto de la substitución en las posiciones 3 y 4 se obtiene en producciones bajas.
En 1994 un reporte liberado por 5 importantes compañías de cigarrillo, el pirrol es uno de los 599 aditivos de los cigarrillos. Su uso o propósito, sin embargo, es desconocido.

El pirrol tiene una muy baja basicidad comparada a las aminas más comunes y a otros compuestos aromáticos como la piridina. Está disminuida basicidad relativa es causada por la deslocalización electrónica del par solitario del átomo de nitrógeno del anillo aromático. Luego el pirrol es una base muy débil con un pKa de alrededor de -4. La protonación del pirrol resulta en la pérdida de su aromaticidad y por lo tanto, la misma es termodinámicamente desfavorable.
Como muchas otras aminas, el pirrol se oscurece al estar expuesto al aire y la luz por lo que necesita ser destilado inmediatamente antes de usarlo.
La preparación de sistemas heterocíclicos de cinco miembros con un nitrógeno como heteroátomo parte de diversas estrategias retrosintéticas:
El pirrol es preparado a nivel industrial mediante el tratamiento del furano con amoníaco en presencia de un catalizador sólido ácido. Se forma succinaldehído como intermediario y la ciclización se lleva a cabo por medio de una reacción tipo Paal-Knorr.
Las maleimidas se pueden preparar por aminólisis del anhídrido maleico en donde se forma la semiamida maleica como intermediario:
De la misma forma, la succinimida se forma por calentamiento del succinato de amonio:
La 2-pirrolidona se prepara por amonólisis de la butirolactona en donde se forma la 4-hidroxibutiramida como intermediario:
También se prepara 2-pirrolidona a partir de succinonitrilo , el cual se hidrogena parcialmente —usando níquel Raney como catalizador— a 3-aminopropionitrilo, para luego hidrolizarse con agua a presión y a 210 °C:
Otra vía sintética del pirrol involucra la descarboxilación del mucato de amonio, una sal de amonio del ácido múcico. Normalmente, la sal es calentada en un aparato de destilación con glicerol como solvente.
El nitrógeno de la imina-enamina reacciona con el carbono unido al halógeno en una reacción de SN2. De esta manera se forma un sistema 4-enaminocarbonílico (6). Este intermediario es el que da el cierre 1,2 del sistema pirrólico:
En el segundo paso, tiene lugar una reacción sigmatrópica[3,3] entre los dos intermediarios de la reacción. El pirrol, finalmente, puede ser polimerizado para producir polipirrol.
b) Conexión en las posiciones 3-4

c) Conexión en las posiciones 2-3
d) Otras estrategias de conexión.
El protón NH en los pirroles es moderadamente ácido con un pKa de 16.5. El pirrol puede entonces ser desprotonado con bases fuertes como el butil-litio o el hidruro de sodio. El pirroluro resultante es nucleófilico. Luego al tratar esta base conjugada con un electrófilo como el ioduro de metilo nos da N-metilpirrol.
Las estructuras contribuyentes de resonancia del pirrol nos da un punto de vista más cercano a la reactividad del compuesto. Como el furano y el tiofeno, el pirrol es más reactivo que el benceno frente a la sustitución electrofilica aromática debido a que el mismo es capaz de estabilizar la carga positiva en el carbocatión intermedio.
Luego el pirrol experimenta la sustitución electrofílica aromática(SEAr) predominantemente en las posiciones 2 y 5. Dos reacciones especialmente notables destinadas a la producción de pirroles funcionalizados (con distintos grupos funcionales) son la Reacción de Mannich y la Reacción de Vilsmeier-Haack (abajo), las cuales son compatibles con una gran variedad de sustratos pirrólicos.
También el pirrol reacciona con aldehídos para dar porfirinas. Por ejemplo, el benzaldehído se condensa con el pirrol para dar tetrafenilporfirina. Además, los compuestos del pirrol pueden también participar en cicloadiciones como en la reacción de Diels-Alder bajo ciertas condiciones, por ejemplo, en presencia de catálisis ácida (de Lewis), calentamiento o alta presión.

El pirrol también polimeriza en la luz. Por lo que se puede usar un agente oxidante como el persulfato de amonio a 0 °C en la oscuridad, para controlar la polimerización.
El pirrol no tiene una aplicación comercial significativa, pero el N-metilpirrol es un precursor del ácido N-metilpirrolcarboxílico, el cual se usa como precursor en la industria farmacéutica.
Escribe un comentario o lo que quieras sobre Pirrol (directo, no tienes que registrarte)
Comentarios
(de más nuevos a más antiguos)
Aún no hay comentarios, ¡deja el primero!